Введите слово или словосочетание на любом языке 👆
Язык:
Перевод и анализ слов искусственным интеллектом ChatGPT
На этой странице Вы можете получить подробный анализ слова или словосочетания, произведенный с помощью лучшей на сегодняшний день технологии искусственного интеллекта:
- как употребляется слово
- частота употребления
- используется оно чаще в устной или письменной речи
- варианты перевода слова
- примеры употребления (несколько фраз с переводом)
- этимология
Что (кто) такое Нормальный элемент - определение
Нормальные элементы
Найдено результатов: 348
НОРМАЛЬНЫЙ ЭЛЕМЕНТ
гальванический элемент, электродвижущая сила которого стабильна при постоянной температуре и давлении. Положительный электрод нормального элемента - Hg, отрицательный - амальгама кадмия или цинка, электролит - водный раствор сульфата кадмия или цинка. Различают нормальный элемент насыщенный (электродвижущая сила 1,0185=1,0187 В) и ненасыщенный (электродвижущая сила 1,0186=1,0194 В). Используют в качестве образцовой меры электродвижущей силы и источника опорной электродвижущей силы в измерительных приборах.
Нормальный элемент
гальванический элемент, значение эдс которого весьма стабильно во времени и воспроизводимо от экземпляра к экземпляру. Различают насыщенные и ненасыщенные (в зависимости от концентрации электролита) Н. э. Наилучшей стабильностью и воспроизводимостью обладают образцовые насыщенные Н. э. Вестона (рис.). Ненасыщенные Н. э. Вестона отличаются от насыщенных тем, что их электролит - водный раствор CdSO4 - при температурах свыше 4 °С не содержит кристаллов 3 CdSO4 · 8H2O. Диапазон значений эдс при 20 °С у насыщенных Н. э. Вестона 1,01850-1,01870 в с точностью до 10-5; у ненасыщенных Н. э. 1,0186-1,0194 в с точностью до 10-4. Действительное значение эдс насыщенного Н. э. при температуре t, отличной от 20 °С, определяют по формуле:
Et = E20 - 0,00004 (t - 20) - 0,000001(t - 20)2в,
где E20 - эдс Н. э. при 20 °С. Для ненасыщенных Н. э. изменение эдс с темпрой обычно не учитывается.
В Н. э. Кларка при таком же, как у Н. э. Вестона, положительном электроде отрицательным электродом служит 10\% -я амальгама цинка, а электролитом - насыщенный раствор ZnSO4 с избытком кристаллов ZnSO4 · 7H2O. В интервале температур от 0 до 30 °С их эдс 1,432 в. В СССР Н. э. Кларка практически не применяются.
Насыщенные Н. э. используют в качестве образцовых мер эдс при точных электрических измерениях; они чувствительны к тряске и опрокидыванию. Ненасыщенные Н. э. используют как источники опорных эдс в промышленных и переносных электроизмерительных приборах; они значительно более устойчивы к механическим воздействиям, чем насыщенные Н. э.
Лит.: Электрические измерения. Средства и методы измерений, под ред. Е. Г. Шрамкова, М., 1972.
Схема устройства насыщенного нормального элемента Вестона с жидким (а) и без жидкого (б) электролита: 1 - отрицательный электрод (амальгама кадмия - 10\% Cd, 90\% Hg); 2 - кристаллы 3CdSO4 ( 8H2O; 3 - электролит - насыщенный водный раствор CdSO4; 4 - положительный электрод (Hg); 5 - паста из Hg2SO4 (деполяризатор), растёртого с Hg и кристаллами 3CdSO4·8H2O; 6 - корковая пробка; 7 - синтетическая смола; выводы от электродов изготовлены из платиновой проволоки.
Нормальный элемент
Нормальный элемент — обратимый гальванический элемент с высокостабильным значением ЭДС, применяемый для измерительных целей
Нормальный алгоритм
Норма́льный алгори́тм (алгори́фм) Ма́ркова (НАМ, также марковский алгоритм) — один из стандартных способов формального определения понятия алгоритма (другой известный способ — машина Тьюринга). Понятие нормального алгоритма введено А.
Нормальный алгорифм
одно из современных уточнений понятия Алгоритма, получившее распространение в исследованиях по конструктивной математике (См. Конструктивная математика). Предложено в 1950 А. А. Марковым, впервые систематически и строго построившим на основе этого уточнения общую алгоритмов теорию (См. Алгоритмов теория). Н. а. эквивалентны частично-рекурсивным функциям (см. Рекурсивные функции), а следовательно, и Тьюринга машинам.
Концепция Н. а. специально приспособлена для реализации алгоритмов, действующих над словами в тех или иных алфавитах. При этом под алфавитом в математике понимается любой конечный набор четко отличимых друг от друга графических символов (букв), а под словом в данном алфавите - произвольная конечная цепочка букв этого алфавита. Цепочка, вовсе не содержащая букв, также считается словом в данном алфавите (пустое слово). Например, цепочки "ииаам", "книга", "гамма" являются словами в русском алфавите, а также в шестибуквенном алфавите {к, н, и, г, а, м}. Элементарным актом преобразования слов в алгоритмических процессах, задаваемых Н. а., является т. н. операция "подстановки вместо первого вхождения". Пусть Р, Q, R - слова в некотором алфавите. Результатом подстановки Q вместо первого вхождения Р в R называется слово ∑ (R, Р, Q), получаемое следующим образом. Если Р входит в R, т.е. R представимо в виде S1PS2, то среди таких представлений отыскивается представление с наиболее коротким словом S1 и полагается ∑ (R, Р, Q) = S1QS2. Если же Р не входит в R, то ∑ (R, Р, Q) = R. Так, ∑ (гамма, а, е) = гемма.
Для задания Н. а. 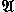 необходимо фиксировать некоторый алфавит А, не содержащий букв "→" и " · ", и упорядоченный список слов вида Р → Q (простая формула подстановки) или Р → · Q (заключит. формула подстановки), где Р и Q - слова в А. Формулы подстановок принято записывать друг под другом в порядке следования, объединяя их слева фигурной скобкой. Получающаяся фигура называется схемой Н. а. Исходными данными и результатами работы Н. а.
необходимо фиксировать некоторый алфавит А, не содержащий букв "→" и " · ", и упорядоченный список слов вида Р → Q (простая формула подстановки) или Р → · Q (заключит. формула подстановки), где Р и Q - слова в А. Формулы подстановок принято записывать друг под другом в порядке следования, объединяя их слева фигурной скобкой. Получающаяся фигура называется схемой Н. а. Исходными данными и результатами работы Н. а.  являются слова в А (сам Н. а.
являются слова в А (сам Н. а.  называется Н. а. в алфавите А). Процесс применения к слову R Н. а.
называется Н. а. в алфавите А). Процесс применения к слову R Н. а.  со схемой вида
со схемой вида
 являются слова в А (сам Н. а.
являются слова в А (сам Н. а.  называется Н. а. в алфавите А). Процесс применения к слову R Н. а.
называется Н. а. в алфавите А). Процесс применения к слову R Н. а.  со схемой вида
со схемой вида где δi (1 ≤ i ≤ n) означает "→" или "→", разворачивается следующим образом. Отыскивается наименьшее i, при котором Pi входит в R. Если все Pi не входят в R, то работа  заканчивается и её результатом считается R. Если требуемое i найдено, то переходят к слову ∑ (R, Pi, Qi). При этом в случае, если использованная формула подстановки PiδiQi была заключительной (δi = → ), работа
заканчивается и её результатом считается R. Если требуемое i найдено, то переходят к слову ∑ (R, Pi, Qi). При этом в случае, если использованная формула подстановки PiδiQi была заключительной (δi = → ), работа  заканчивается и результатом считается ∑ (R, Pi, Qi). Если же формула PiδiQi - простая, то описанная процедура повторяется с заменой R на ∑ (R, Ri, Qi).
заканчивается и результатом считается ∑ (R, Pi, Qi). Если же формула PiδiQi - простая, то описанная процедура повторяется с заменой R на ∑ (R, Ri, Qi).
 заканчивается и её результатом считается R. Если требуемое i найдено, то переходят к слову ∑ (R, Pi, Qi). При этом в случае, если использованная формула подстановки PiδiQi была заключительной (δi = → ), работа
заканчивается и её результатом считается R. Если требуемое i найдено, то переходят к слову ∑ (R, Pi, Qi). При этом в случае, если использованная формула подстановки PiδiQi была заключительной (δi = → ), работа  заканчивается и результатом считается ∑ (R, Pi, Qi). Если же формула PiδiQi - простая, то описанная процедура повторяется с заменой R на ∑ (R, Ri, Qi).
заканчивается и результатом считается ∑ (R, Pi, Qi). Если же формула PiδiQi - простая, то описанная процедура повторяется с заменой R на ∑ (R, Ri, Qi). Пример. Натуральные числа можно рассматривать как слова в алфавите {О, 1} вида 0, 01, 01l,... Н. а. в этом алфавите со схемами {0 → · 01 и {1→ переводят каждое натуральное число п соответственно в n + 1 и в 0.
Множество всех Н. а. замкнуто относительно известных способов комбинирования алгоритмов. Например, по любым двум Н. а.  и
и 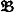 можно построить Н. а.
можно построить Н. а. 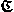 , являющийся композицией
, являющийся композицией  и
и  , т. е. реализующий следующий интуитивный алгоритм: "сначала выполнить алгоритм
, т. е. реализующий следующий интуитивный алгоритм: "сначала выполнить алгоритм  , затем к результату применять
, затем к результату применять  ".
".
 и
и 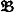 можно построить Н. а.
можно построить Н. а.  и
и  , т. е. реализующий следующий интуитивный алгоритм: "сначала выполнить алгоритм
, т. е. реализующий следующий интуитивный алгоритм: "сначала выполнить алгоритм  , затем к результату применять
, затем к результату применять  ".
". Соотношение между интуитивными алгоритмами и Н. а. описывается выдвинутым А. А. Марковым принципом нормализации: всякий алгоритм, перерабатывающий слова в данном алфавите А в слова в этом же алфавите, может быть реализован посредством Н. а. в некотором расширении А. [Легко указать очень простые алгоритмы в А, не реализуемые Н. а. в A; с другой стороны, всегда можно ограничиться двухбуквенным (и даже однобуквенным) расширением A.] Принцип нормализации эквивалентен тезису Чёрча и, аналогично последнему, не может быть доказан из-за неточности интуитивной концепции алгоритма.
Лит.: Марков А. А., Теория алгорифмов, М. - Л., 1954 (Тр. Математического института АН СССР, т. 42); Мендельсон Э., Введение в математическую логику, пер. с англ., М., 1971.
Б. А. Кушнер.
Лекланше элемент
ПЕРВИЧНЫЙ ХИМИЧЕСКИЙ ИСТОЧНИК ЭДС
Элемент Лекланше; Сухой элемент; Лекланше элемент; Сухая батарея; Солевой элемент
гальванический элемент, в котором положительный электрод изготавливается из двуокиси марганца с добавкой графита и сажи, отрицательный - из цинка. Л. э. был предложен в 1865 французским химиком Ж. Лекланше (G. Leclanche) и первоначально состоял из цинкового стаканчика, заполненного водным раствором хлористого аммония или др. хлористых солей (электролит), с помещенным в него агломератом из двуокиси марганца с угольным токоотводом. В более поздних конструкциях "сухих" Л. э. электролит стали загущать крахмалистыми веществами. Начальное напряжение такого Л. э. - 1,4-1,6 в, конечное - 0,7-0,9 в, удельная энергия (w) 30-50 вт·ч/кг. В 30 - 40-х гг. 20 в. были разработаны Л. э. галетной конструкции с w 40-60 вт·ч/кг. В 60-х гг. появились Л. э. со щелочным электролитом - раствором едкого кали (1,4-1,66; 0,9-1,0 б; w 60-90 вт·ч/кг), которые стали постепенно вытеснять Л. э. с солевым электролитом. Л. э. - наиболее дешёвые и удобные химические источники тока: они хорошо сохраняются, транспортабельны, не требуют специального ухода, всегда готовы к действию. Широко применяются для питания переносной радиоаппаратуры, карманных фонарей, электрочасов, электроигрушек и т. п. См. также Химические источники тока.
ЛЕКЛАНШЕ ЭЛЕМЕНТ
ПЕРВИЧНЫЙ ХИМИЧЕСКИЙ ИСТОЧНИК ЭДС
Элемент Лекланше; Сухой элемент; Лекланше элемент; Сухая батарея; Солевой элемент
наиболее распространенный гальванический элемент, используемый в электронных часах, радиоаппаратуре, игрушках и т. п. Изобретен в 1865 французским ученым Ж. Лекланше. Положительный электрод выполнен из диоксида марганца с добавкой графита и сажи, отрицательный - из цинка, электролит состоит из хлоридов калия, цинка, кальция. Электродвижущая сила до 1,65 В.
Марганцево-цинковый элемент
ПЕРВИЧНЫЙ ХИМИЧЕСКИЙ ИСТОЧНИК ЭДС
Элемент Лекланше; Сухой элемент; Лекланше элемент; Сухая батарея; Солевой элемент
Марганцево-цинковый элемент, солевой элемент питания, также известный как элемент Лекланше — это первичный химический источник тока, в котором катодом является диоксид марганца MnO2 (пиролюзит) в смеси с графитом (около 9,5 %), электролитом — раствор хлорида аммония NH4Cl, анодом — металлический цинк Zn.
ЭЛЕМЕНТ ХИМИЧЕСКИЙ
СОВОКУПНОСТЬ АТОМОВ С ОДИНАКОВЫМ ЗАРЯДОМ ЯДРА И ЧИСЛОМ ПРОТОНОВ, СОВПАДАЮЩИМ С ПОРЯДКОВЫМ (АТОМНЫМ) НОМЕРОМ В ТАБЛИЦЕ МЕНДЕЛЕЕВА
Химические элементы; Элементы химические; Элемент (химия); Элемент химический
совокупность атомов с одинаковым зарядом ядра. Известно 109 элементов химических (1993); 21 из них впервые были получены искусственно (Tc, Pm, At, Fr, Np, Pu и 15 элементов от N 95 до 109), причем Tc, Pm, Fr, Np позже в ничтожных количествах обнаружены в природе. На Земле наиболее распространены O, Si, Al, Fe, Cu, Na, K, Mg, Ti, Mn; эти химические элементы составляют 99,92% массы земной коры. См. также: Периодическая система элементов Менделеева.
Элементы химические
СОВОКУПНОСТЬ АТОМОВ С ОДИНАКОВЫМ ЗАРЯДОМ ЯДРА И ЧИСЛОМ ПРОТОНОВ, СОВПАДАЮЩИМ С ПОРЯДКОВЫМ (АТОМНЫМ) НОМЕРОМ В ТАБЛИЦЕ МЕНДЕЛЕЕВА
Химические элементы; Элементы химические; Элемент (химия); Элемент химический
Каждый Э. х. - это совокупность Атомов с одинаковым зарядом атомных ядер и одинаковым числом электронов в атомной оболочке. Ядро атомное состоит из протонов, число которых равно атомному номеру (См. Атомный номер) элемента, и нейтронов, число которых может быть различным. Разновидности атомов одного и того же Э. х., имеющие различные массовые числа (См. Массовое число) (равные сумме масс протонов и нейтронов, образующих ядро), называются изотопами (См. Изотопы). В природе многие Э. х. представлены двумя или большим числом изотопов. Известно 276 стабильных изотопов, принадлежащих 81 природному Э. х., и около 1500 радиоактивных изотопов. Изотопный состав природных элементов на Земле, как правило, постоянен; поэтому каждый элемент имеет практически постоянную атомную массу (См. Атомная масса), являющуюся одной из важнейших характеристик элемента. В настоящее время (1978) известно 107 Э. х., они, преимущественно нерадиоактивные, создают всё многообразие простых и сложных веществ. Простое вещество - форма существования элемента в свободном виде. Некоторые Э. х. существуют в двух или более аллотропных модификациях (например, углерод в виде графита и алмаза), различающихся по физическим и химическим свойствам; число простых веществ достигает 400 (см. Аллотропия). Иногда понятия "элемент" и "простое вещество" отождествляются, поскольку в подавляющем большинстве случаев нет различия в названиях Э. х. и образуемых ими простых веществ; "... тем не менее в понятиях такое различие должно всегда существовать", - писал в 1869 Д. И. Менделеев (Соч., т. 13, 1949, с. 490). Сложное вещество - Соединение химическое - состоит из химически связанных атомов двух или нескольких различных элементов; известно более 100 тыс. неорганических и более 3 млн. органических соединений. Для обозначения Э. х. служат Знаки химические, состоящие из первой или первой и одной из последующих букв латинского названия элемента. В формулах химических (См. Формулы химические) и уравнениях химических (См. Уравнения химические) каждый такой знак (символ) выражает, кроме названия элемента, относительную массу Э. х., равную его атомной массе. Изучение Э. х. составляет предмет химии (См. Химия), в частности неорганической химии (См. Неорганическая химия).
Историческая справка. В донаучный период химии как нечто непреложное принималось учение Эмпедокла о том, что основу всего сущего составляют четыре стихии: огонь, воздух, вода, земля. Это учение, развитое Аристотелем, полностью восприняли алхимики. В 8-9 вв. они дополнили его представлением о сере (начале горючести) и ртути (начале металличности) как составных частях всех металлов. В 16 в. возникло представление о соли как начале нелетучести, огнепостоянства. Против учения о 4 стихиях и 3 началах выступил Р. Бойль, который в 1661 дал первое научное определение Э. х. как простых веществ, которые не состоят из каких-либо других веществ или друг из друга и образуют все смешанные (сложные) тела. В 18 в. Почти всеобщее признание получила гипотеза И. И. Бехера и Г. Э. Шталя (См. Шталь), согласно которой тела природы состоят из воды, земли и начала горючести - Флогистона. В конце 18 в. эта гипотеза была опровергнута работами А. Л. Лавуазье. Он определил Э. х. как вещества, которые не удалось разложить на более простые и из которых состоят другие (сложные) вещества, т. е. по существу повторил формулировку Бойля. Но, в отличие от него, Лавуазье дал первый в истории науки перечень реальных Э. х. В него вошли все известные тогда (1789) неметаллы (О, N, Н, S, Р, С), металлы (Ag, As, Bi, Co, Ca, Sn, Fe, Mn, Hg, Mo, Ni, Au, Pt, Pb, W, Zn), а также "радикалы" [муриевый (Cl), плавиковый (F) и борный (В)] и "земли" - ещё не разложенные известь СаО, магнезия MgO, барит BaO, глинозём Al2O3 и кремнезём SiO2 (Лавуазье полагал, что "земли" - вещества сложные, но пока это не было доказано на опыте, считал их Э. х.). Как дань времени он включил в список Э. х. невесомые "флюиды" - свет и теплород. Едкие щёлочи NaOH и KOH он считал веществами сложными, хотя разложить их электролизом удалось позже - только в 1807 (Г. Дэви). Разработка Дж. Дальтоном атомной теории имела одним из следствий уточнение понятия элемента как вида атомов с одинаковой относительной массой (атомным весом). Дальтон в 1803 составил первую таблицу атомных масс (отнесённых к массе атома водорода, принятой за единицу) пяти Э. х. (О, N, С, S, Р). Тем самым Дальтон положил начало признанию атомной массы как главной характеристики элемента. Дальтон, следуя Лавуазье, считал Э. х. веществами не разложимыми на более простые.
Последующее быстрое развитие химии привело, в частности, к открытию большого числа Э. х. В списке Лавуазье было всего 25 Э. х., включая "радикалы", но не считая "флюиды" и "земель". Ко времени открытия периодического закона Менделеева (См. Периодический закон Менделеева) (1869) было известно уже 63 элемента. Открытие Д. И. Менделеева позволило предвидеть существование и свойства ряда неизвестных тогда Э. х. и явилось основой для установления их взаимосвязи и классификации.
Открытие радиоактивности (См. Радиоактивность) в конце 19 в. поколебало более чем столетнее убеждение в том, что атомы нельзя разложить. В связи с этим почти до середины 20 в. продолжалась дискуссия о том, что такое Э. х. Конец ей положила современная теория строения атома, которая позволила дать строго объективную дефиницию Э. х., приведённую в начале статьи.
Распространённость в природе. Распространённость Э. х. в космосе определяется нуклеогенезом внутри звёзд. Химический состав Солнца, планет земного типа Солнечной системы и метеоритов, по-видимому, практически тождествен. Образование ядер Э. х. связано с различными ядерными процессами в звёздах. Поэтому на разных этапах своей эволюции различные звёзды и звёздные системы имеют неодинаковый химический состав (см. Космогония). Распространённость и распределение Э. х. во Вселенной, процессы сочетания и миграции атомов при образовании космического вещества, химический состав космических тел изучает Космохимия. Основную массу космического вещества составляют Н и Не (99,9\%). Наиболее разработанной частью космохимии является Геохимия.
Из 107 Э. х. только 89 обнаружены в природе, остальные, а именно Технеций (атомный номер 43), Прометий (атомный номер 61), Астат (атомный номер 85), Франций (атомный номер 87) и Трансурановые элементы, получены искусственно посредством ядерных реакций (ничтожные количества Te, Pm, Np, Fr образуются при спонтанном делении урана и присутствуют в урановых рудах). В доступной части Земли наиболее распространены 10 элементов с атомными номерами в интервале от 8 до 26. В земной коре они содержатся в следующих относительных количествах:
Перечисленные 10 элементов составляют 99,92\% массы земной коры.
Классификация и свойства. Наиболее совершенную естественную классификацию Э. х., раскрывающую их взаимосвязь и показывающую изменение их свойств в зависимости от атомного номера, даёт Периодическая система элементов Д. И. Менделеева. По свойствам Э. х. делятся на Металлы и Неметаллы, причём периодическая система позволяет провести границу между ними. Для химических свойств металлов наиболее характерна проявляемая при химических реакциях способность отдавать внешние электроны и образовывать катионы, для неметаллов - способность присоединять электроны и образовывать анионы. Неметаллы характеризуются высокой Электроотрицательностью. Различают Э. х. главных подгрупп, или непереходные элементы, в которых идёт последовательное заполнение электронных подоболочек s и р, и Э. х. побочных подгрупп, или переходные, в которых идёт достраивание d- и f-подоболочек. При комнатной температуре два Э. х. существуют в жидком состоянии (Hg и Вг), одиннадцать - в газообразном (Н, N, О, F, Cl, Не, Ne, Ar, Kr, Xe, Rn), остальные - в виде твёрдых тел, причём температура плавления их колеблется в очень широких пределах - от около 30°С (Cs 28,5°С; Ga 29,8°С) до 3000°С и выше (Ta 2996°С; W 3410°С; графит около 3800± 200°С под давлением 125 кбар). О свойствах, получении и применении Э. х. см. в статьях об отдельных элементах, а также о семействах Э. х. (Актиноиды, Инертные газы, Лантаноиды, Платиновые металлы, Рассеянные элементы, Редкие элементы, Редкоземельные элементы).
Лит.: Кедров Б. М., Эволюция понятия элемента в химии, М., 1956; Сиборг Г. Т., Вэленс Э. Г., Элементы Вселенной, пер. с англ., М., 1962; Сиборг Г., Искусственные трансурановые элементы, пер. с англ., М., 1965; Фигуровский Н. А., Открытие химических элементов и происхождение их названий, М., 1970; Популярная библиотека химических элементов, М., 1971-73; Некрасов Б. В., Основы общей химии, 3 изд., [т.] 1-2, М., 1973; Полинг Л., Общая химия, пер. с англ., М., 1974; Джуа М., История химии, пер. с итал., 2 изд., М., 1975; Weeks М. Е., Discovery of the elements, 6 ed., Easton, 1956.
С. А. Погодин.
Википедия
Нормальный элемент

Нормальный элемент — обратимый гальванический элемент с высокостабильным значением ЭДС, применяемый для измерительных целей



![Марганцево-цинковый элемент. <br />(1) — металлический колпачок, <br />(2) — [[графит]]овый электрод («+»), <br />(3) — [[цинк]]овый стакан («—»), <br />(4) — оксид марганца, <br />(5) — электролит, <br />(6) — металлический контакт. Марганцево-цинковый элемент. <br />(1) — металлический колпачок, <br />(2) — [[графит]]овый электрод («+»), <br />(3) — [[цинк]]овый стакан («—»), <br />(4) — оксид марганца, <br />(5) — электролит, <br />(6) — металлический контакт.](https://commons.wikimedia.org/wiki/Special:FilePath/Zincbattery.png?width=200)

.jpg?width=200)
.jpg?width=200)
.jpg?width=200)
